Es un modelo que describe a los electrones girando a diferentes distancias del núcleo y, se basa en estos postulados:
- Los electrones giran en órbitas circulares alrededor del núcleo. En éstas, los electrones poseen una energía determinada.
- Solo son estables las órbitas en las que el momento angular del electrón es un múltiplo de la constante de Planck dividida por 2
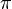 (donde n=1,2,3...)
(donde n=1,2,3...)
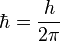
- La emisión o absorción de energía de un átomo corresponde con el tránsito electrónico entre diferentes órbitas: si un electrón absorbe fotones de energía, pasa de una órbita más interna a otra más externa; si un electrón pasa de una órbita más externa a otra más interna, emite fotones de energía.
Siendo esa Rh la constante de Ryderberg. La órbita más baja corresponde a n=1 y se llama nivel fundamental. Cuanto mayor es n, mayor es la energía del nivel considerado.
- Un electrón no varía su energía cuando se mueve en una misma órbita, pero sí lo hace al cambiar de órbita, ya que se modifica el número cuántico principal (n).
- La energía intercambiada viene dada por esta expresión:

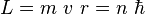


No hay comentarios:
Publicar un comentario